國際糖尿病聯盟研究顯示,大約每3例糖尿病患者中有1例糖尿病性視網膜病變(Diabetic Retinopathy,DR)患者,約 1/3 DR患者合并糖尿病黃斑水腫,這其中又有1/3患者表現為臨床有意義的黃斑水腫[1]。
糖尿病黃斑水腫(Diabetic Macular Edema,DME)在已診斷糖尿病患者中的發病率為5.2%。據估計,我國糖尿病患病率為12.8%,對應糖尿病人群約為1.8億,那么國內DME患病人數預計就應達到1000萬人[2]。
所謂DME,即DR的常見臨床表現,是黃斑區血-視網膜屏障破壞,毛細血管滲漏,細胞外液增加導致的視網膜水腫增厚,是糖尿病患者失明的主要原因。
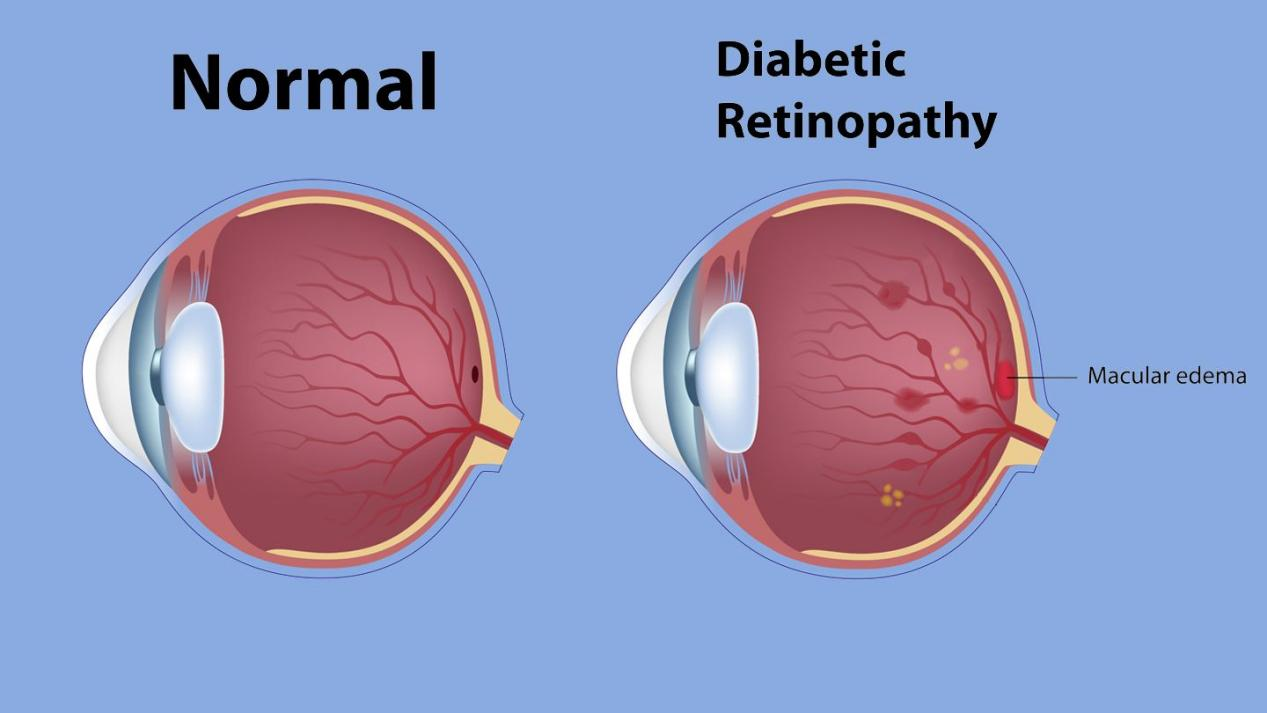
圖 糖尿病視網膜病變(DR)
來源:公開資料
從治療藥物的研發現狀來看,盡管近年來VEGF抑制劑大大降低了DME患者的治療難度,但頻繁玻璃體注射導致的依從性問題及副作用等難題仍待解決。
近千萬患者面臨失明危機
DME的發病機制較為復雜,而血管內皮生長因子(VEGF)在其中扮演著關鍵角色。長期高血糖狀態會導致微血管功能障礙,使得視網膜缺血,這一過程會促使大量VEGF釋放。VEGF具有促進新生血管生成的作用,同時它還能通過破壞視網膜血管內皮細胞的緊密連接,導致血管滲漏,最終引發DME。
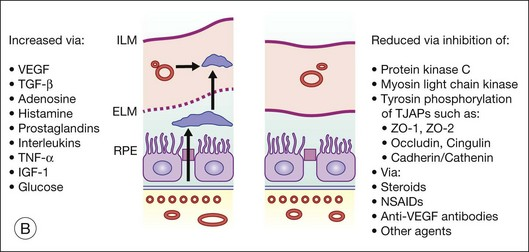
圖 DME的發病機制
來源:公開資料
最早DME治療的金標準是黃斑區激光光凝治療[3]。激光治療在一定程度和時間內可緩解視網膜部分水腫,但僅部分患者視力稍有提高,多數患者的中心視力難以提高,同時會對視功能及視野造成一定程度損害。激光治療有損傷光感受器和毛細血管的可能性,可導致色覺異常、對比敏感度降低和視網膜神經纖維層厚度(RNFL)改變[4]。
2011年,RESTORE研究顯示抗VEGF藥物治療DME患者在視力收益上明顯優于激光治療[5]。從2012年雷珠單抗被批準用于治療DME至今,全球已有阿柏西普、康柏西普等VEGF抑制劑獲批治療DME。
目前,玻璃體腔內注射抗VEGF藥物已成為DME治療的一線療法,抗體藥物可直接通過玻璃體注射入眼內,阻斷血管內皮生長因子(VEGF)的活性,使患者的視網膜功能和形態得到改善,甚至可以阻止或逆轉糖尿病視網膜病變的進展。
表 全球已上市VEGF抑制劑DME藥物
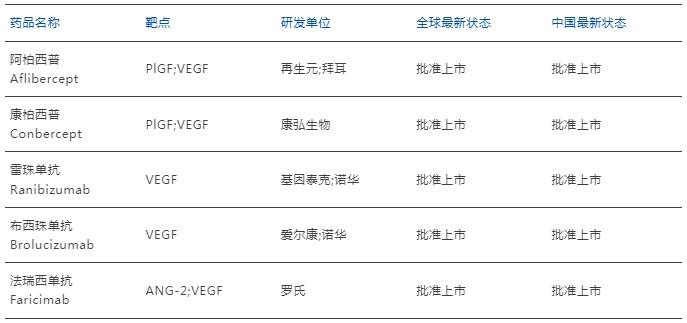
來源:藥智數據,藥智咨詢整理
阿柏西普由再生元和拜耳共同開發,是全球首款上市的VEGF抑制劑,于2011年獲FDA批準上市,商品名Eylea。目前已經先后在美國獲批用于DME、濕性年齡相關性黃斑變性(wAMD)、視網膜靜脈阻塞(RVO)等多個眼科適應癥。研究顯示,阿帕西普在頭對頭實驗中,療效優于雷珠單抗和貝伐珠單抗,視力增益更顯著且注射次數更少;相比激光光凝療法,阿帕西普的解剖學指標改善更佳;同時阿帕西普的嚴重不良事件、眼部嚴重不良事件等安全性與其他藥物相當[6]。
得益于其卓越的療效和廣泛的應用,阿柏西普2022年全球銷售額達到約96億美元,成為再生元的核心產品,也是全球最暢銷的眼科藥物之一。
康柏西普眼用注射液(商品名:朗沐)由康弘生物研發生產,是中國首款原創抗VEGF生物創新藥,于2013年獲批上市。其III期臨床試驗研究顯示,康柏西普能夠顯著改善DME患者的最佳矯正視力(BCVA),患者2年的結果顯示其視力持續提高[7]。
標準療法缺陷與臨床未滿足需求
盡管DME的治療手段變得更為多樣,但仍給患者帶來沉重的健康負擔。即使按目前DME規范的治療方案,仍有30%以上的患者在初期連續治療后仍存在水腫情況,隨診中有更多比例的患者在治療過程中水腫多次復發,長期性的多次治療依舊是目前DME治療的現狀。
目前來看,傳統DME存在以下幾大療法缺陷:
分子量太大:現有VEGF單抗通常是全尺寸抗體,其分子量通常在150kDa左右。雖然能夠有效地結合并中和VEGF,但由于分子量較大,可能限制藥物向目標組織的滲透能力,尤其是在眼部這樣的特殊環境中
半衰期過長:較長的半衰期可能導致藥物在體內停留時間過長,增加潛在副作用的風險。
順應性不佳:抗VEGF藥物均為注射用藥物,目前給藥方式是――眼球內注射(玻璃體腔內注射)。這種給藥方式對于患者的心理壓力較大,而目前的常用的VEGF抑制劑如阿柏西普和康柏西普,DME適應癥均需前5個月每月注射、后續每2月注射,療程較長,對患者負擔較大。
因此,在臨床上迫切需要相比現有VEGF抑制劑,能夠減少注射給藥頻率,增長維持時間的DME治療新技術與新靶點。
全球DME新藥研發格局
據藥智數據顯示,目前全球活躍的在研DME藥物管線共計52條,其中獲批上市的有14款,16款新藥進入了臨床Ⅲ期,22款新藥處于臨床Ⅱ期,10款新藥處于臨床I期。適應癥方面除DME外,常包括年齡相關性黃斑變性、糖尿病視網膜病變等適應癥。
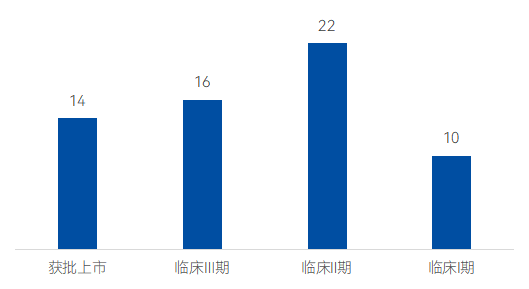
圖 全球DME上市及在研管線臨床階段分布
來源:藥智數據,藥智咨詢整理
從VEGF獨大到多靶點崛起
就靶點方向而言,VEGF仍是目前DME治療領域最成熟的治療靶點,同時也是目前活躍在研管線中管線數量最多的存在。其他發展較成熟的靶點,如PIGF和ANG-2,已上市管線均為同時靶向VEGF的多靶點藥物。
數據顯示,52條上市和在研新藥管線中,VEGF靶點相關管線最多,共涉及29條活躍在研新藥管線;其次是PIGF和ANG-2等靶點方向,分別涉及5款與4款新藥;Intergrin、PDGFRB、IL6、FLT1等靶點也同樣有不少管線涉及。
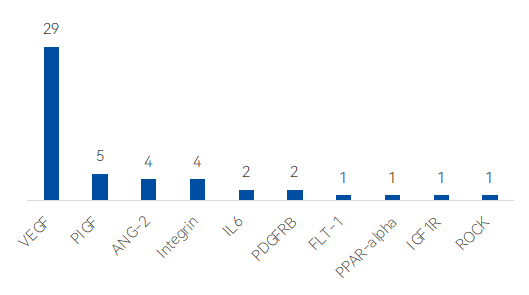
圖 全球DME上市及在研管線靶點分布
來源:藥智數據,藥智咨詢整理
ANG-2全稱為血管生成素-2(Angiopoietin-2),是繼VEGF之后,發現的又一重要血管生成因子,參與生理和病理性的血管新生,其在高糖、缺氧狀態下升高的Ang-2競爭性地與酪氨酸激酶受體結合,會導致血-視網膜屏障破壞及炎癥反應的加劇。由于ANG-2通路的在血管生成和炎癥調控中具有多效性和環境依賴性,甚至可能在不同病理條件下發揮相反作用,單一靶向治療存在局限,促使研究者轉向聯合治療策略。
VEGF和ANG-2同為協同調控血管生成的核心分子。VEGF直接驅動內皮細胞增殖和遷移,ANG-2則通過調節TIE2信號通路,影響血管成熟和穩定性,兩者共同構成血管生成的"開關"機制。在病理狀態下(如腫瘤、眼底病變),VEGF/ANG-2的過度激活會導致血管異常增生和滲漏,而雙重靶向抑制VEGF/ANG-2可更有效地阻斷病理性血管生成。
表 全球上市和在研ANG-2靶點DME藥物
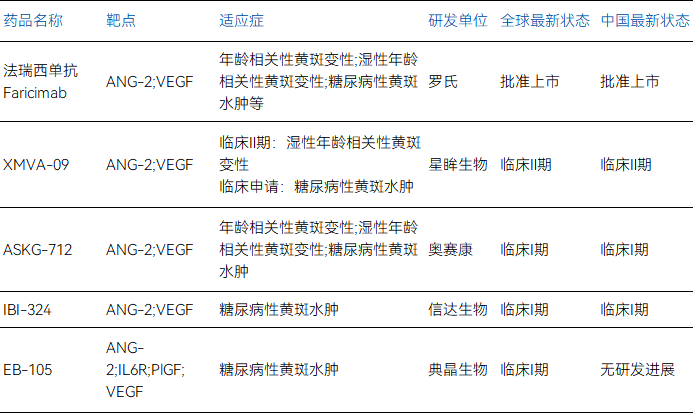
來源:藥智數據,藥智咨詢整理
法瑞西單抗(Faricimab)首個獲批用于眼科的抗VEGF/Ang-2雙靶點人源化IgG1抗體。其能夠同時阻斷VEGF-A和Ang-2兩條通路,理能更全面地抑制導致DME的病理過程,使得用藥時間延長至3-4月注射1次。法瑞西單抗的Ⅱ期臨床研究結果顯示,與0.3mg雷珠單抗相比,6mg法瑞西單抗使BCVA顯著增加。此外,Faricimab引起DME患者CRT的降低及DR嚴重度評分的改善優于雷珠單抗。
整合素(Integrin)是一種存在于細胞膜上,用以介導細胞與細胞、細胞與細胞外基質間相互作用的跨膜蛋白。整合素αVβ3能促進內皮細胞遷移和存活,是血管生成的重要特征。近年來諸多研究證實DR的早期及進展期病變的視網膜上整合素αVβ3及其配體的表達上調,且與DR嚴重程度呈正相關,被認為是參與DME血管生成、炎癥和血管通透性的病理途徑。因此整合素被認為是DME抗血管生成治療的潛在靶點。
表 全球在研Integrin靶點DME藥物
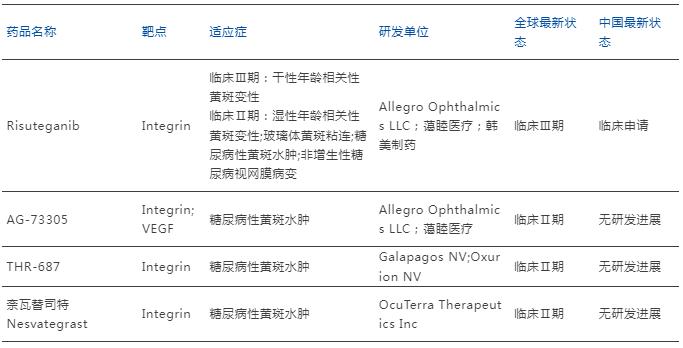
來源:藥智數據,藥智咨詢整理
Risuteganib是一種整合素拮抗劑,可以靶向參與DME病理生理機制的多個整合素異源二聚體,具有改善線粒體功能,減少血管生成,降低細胞毒性的作用。臨床 I 期試驗結果表明,Risuteganib治療后CMT平均降低31%,部分受試者BCVA得到改善。
小分子抗體(scFv)破解注射周期難題
對于技術方向而言,52條新藥管線中,抗體類和化藥整體占比最高,分別有6款和5款新藥上市,各有18款新藥在研;其次是腺相關病毒基因治療和抗體偶聯藥物兩個技術方向,分別有8款和3款新藥在研。
人源化單鏈抗體片段(scFv)是一種重組抗體,通常為約25kDa的單多肽鏈。傳統抗體由兩個重鏈和兩個輕鏈組成,每個臂上有一個抗原結合位點。而scFv相當于一個“迷你版”的抗體,抗原結合位點部分被單獨提取出來,并連接在一起,形成一個單鏈分子。scFv的這種設計去除了不必要的恒定區域,僅保留了必要的抗原結合部分,從而極大減少了分子量。
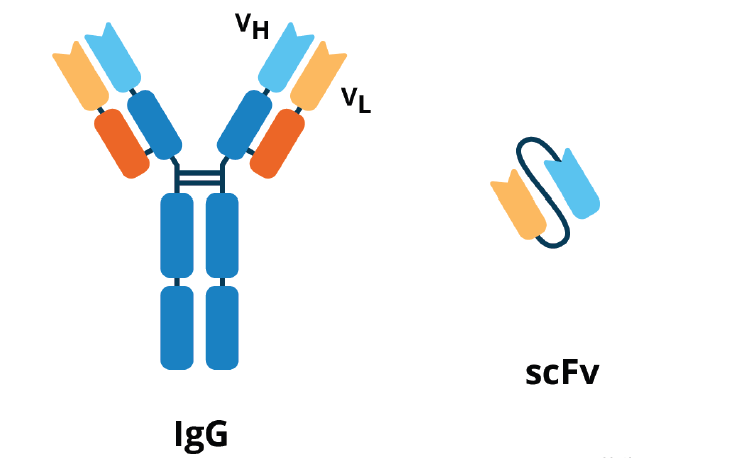
圖 IgG抗體與scFv之間的比較
來源:公開資料
布西珠單抗是采用人源化單鏈抗體片段(scFv)設計,去除不必要的抗體恒定域,布西珠單抗將分子量優化至約26kDa。其顯著較小的分子量為布西珠單抗帶來了多項優勢,包括更好的組織穿透性、更快的清除速度以及更低的免疫原性等。
布西珠單抗的小分子量使其更容易穿過眼睛中的血-視網膜屏障,更容易到達DME處于視網膜深層的病變部位。同時,低分子量的藥物也意味著在相同單位的溶液中,藥物的濃度可以更高,使得布西珠單抗的注射頻率降至每3個月注射1次。
布西珠單抗的III期臨床研究結果顯示,其在52周內視力提升9個字母的速度比阿柏西普組快4倍。具體來說,布西珠單抗組在36周內達到了與阿柏西普組52周相同的視力提升效果(+9個字母)。
同時,布西珠單抗組在52周內無囊狀視網膜水腫(IRF)和漿液性視網膜脫離(SRF)的患者比例顯著高于阿柏西普組[8]。結果表明,布西珠單抗在早期治療中具有更快的視力提升速度,有助于患者更快恢復視力,提高生活質量;在積液控制方面表現出更強的療效,有助于減少視網膜結構的不可逆損傷,提高患者的長期預后。
結語
糖尿病黃斑水腫(DME)作為全球糖尿病患者失明的主要原因之一,在我國影響著約1000萬患者,盡管抗VEGF藥物:如,雷珠單抗和阿柏西普已成為一線療法并顯著改善視力,但頻繁玻璃體注射導致的依從性差、潛在副作用和復發問題,凸顯了當前治療的局限。
新興多靶點藥物如法瑞西單抗(同時靶向VEGF和Ang-2)通過延長注射間隔至3-4個月,整合素拮抗劑如Risuteganib在早期研究中實現視網膜厚度平均降低31%,人源化單鏈抗體片段(scFv)技術(代表藥物布西珠單抗)通過小分子量設計提升組織穿透力,將注射周期減至每3個月一次,為患者提供了更高效、低負擔的選擇。
展望未來,腺相關病毒基因治療、抗體偶聯藥物等新技術賽道與多靶點聯合策略有望突破血-視網膜屏障修復難題,推動DME治療向長效化、個性化方向演進,最終實現更高應答率和功能性治愈的臨床目標。







