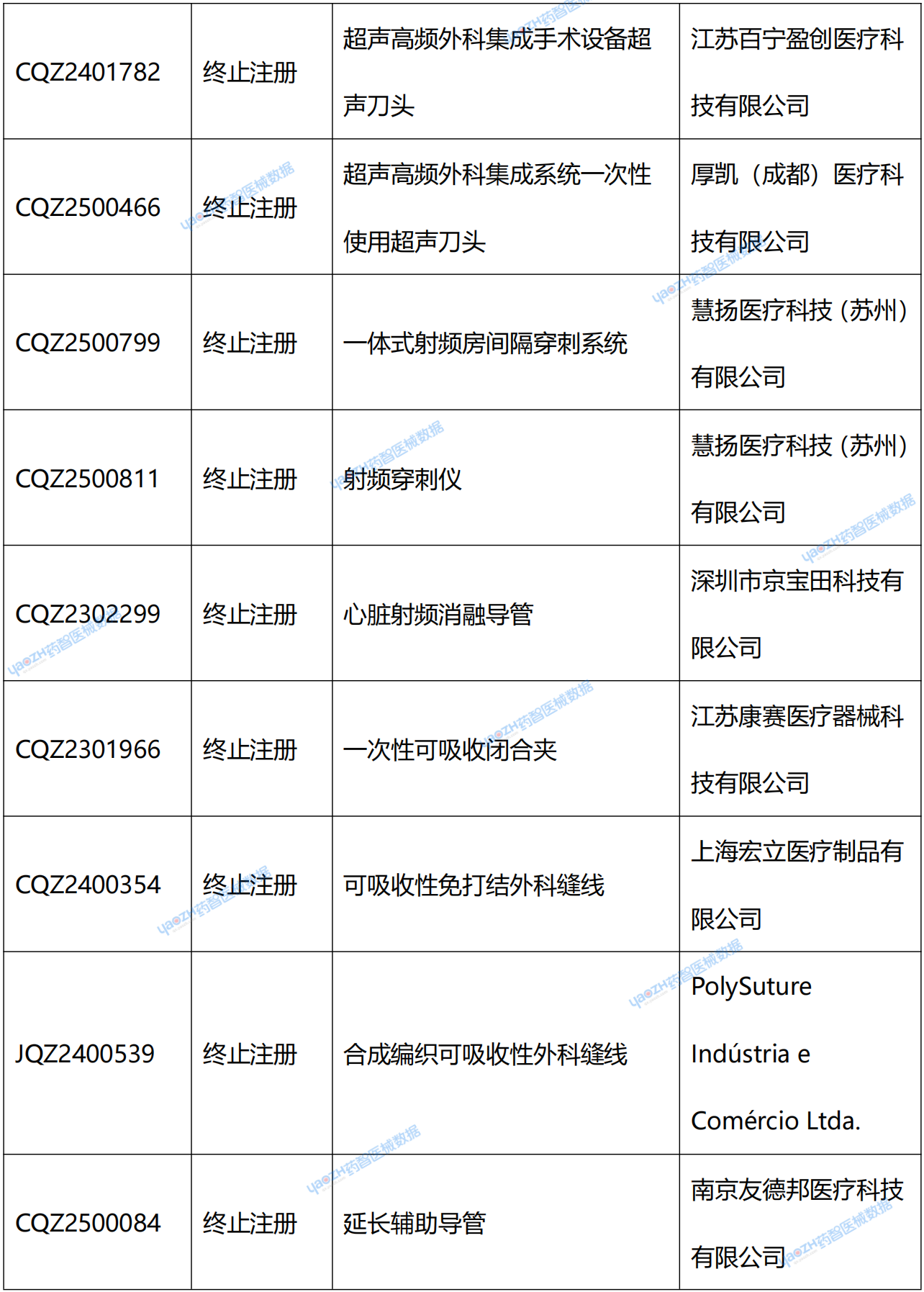
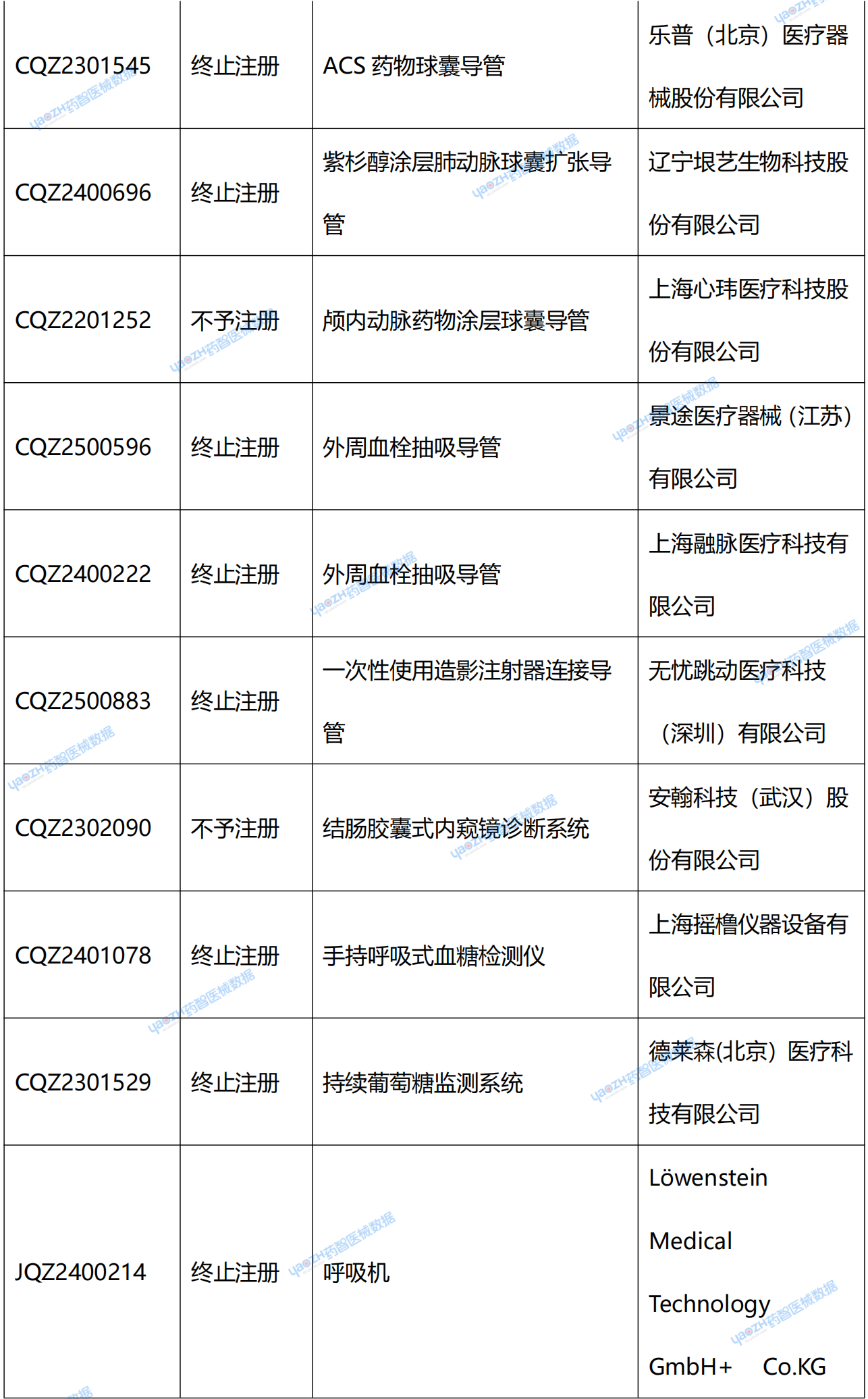
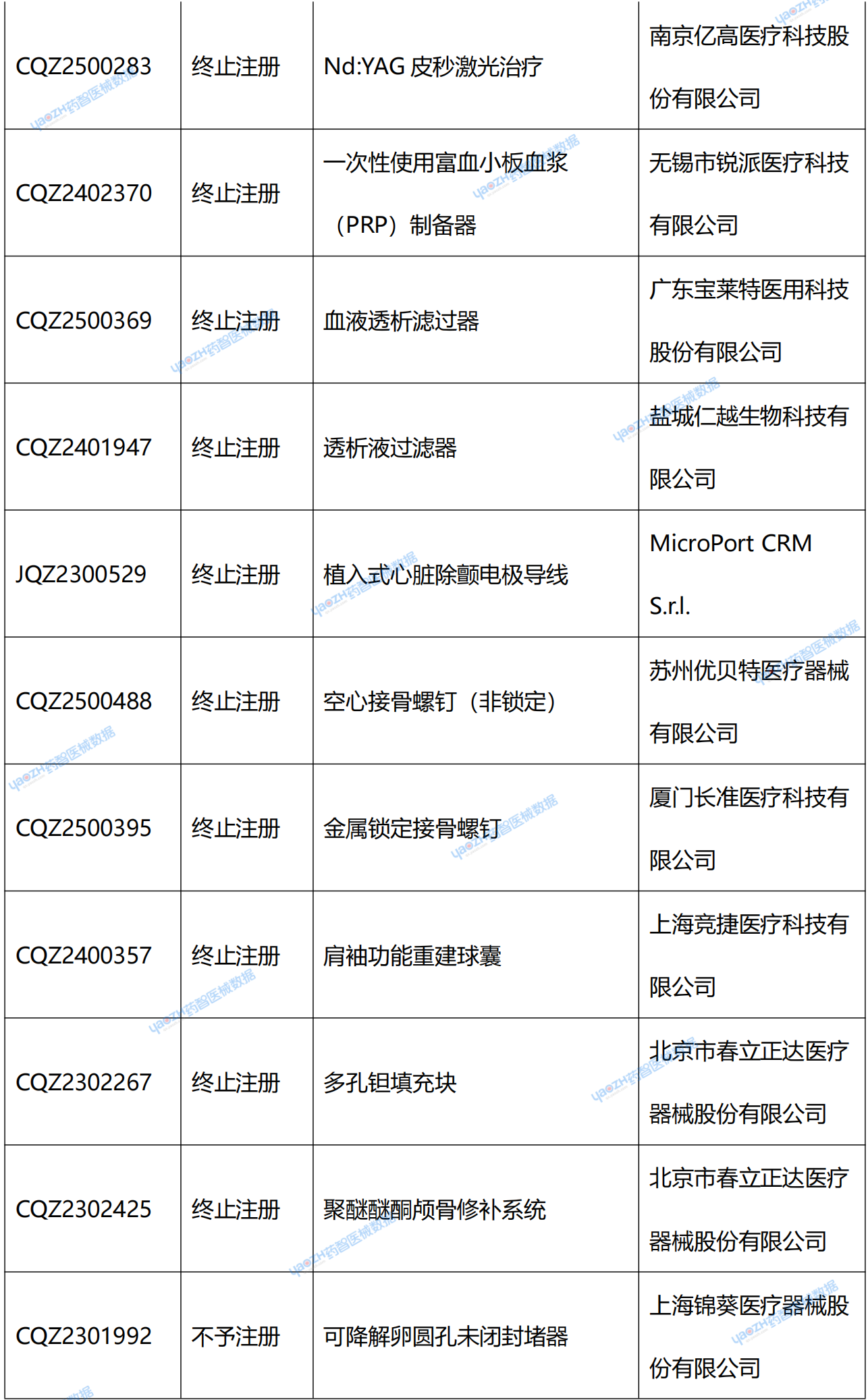
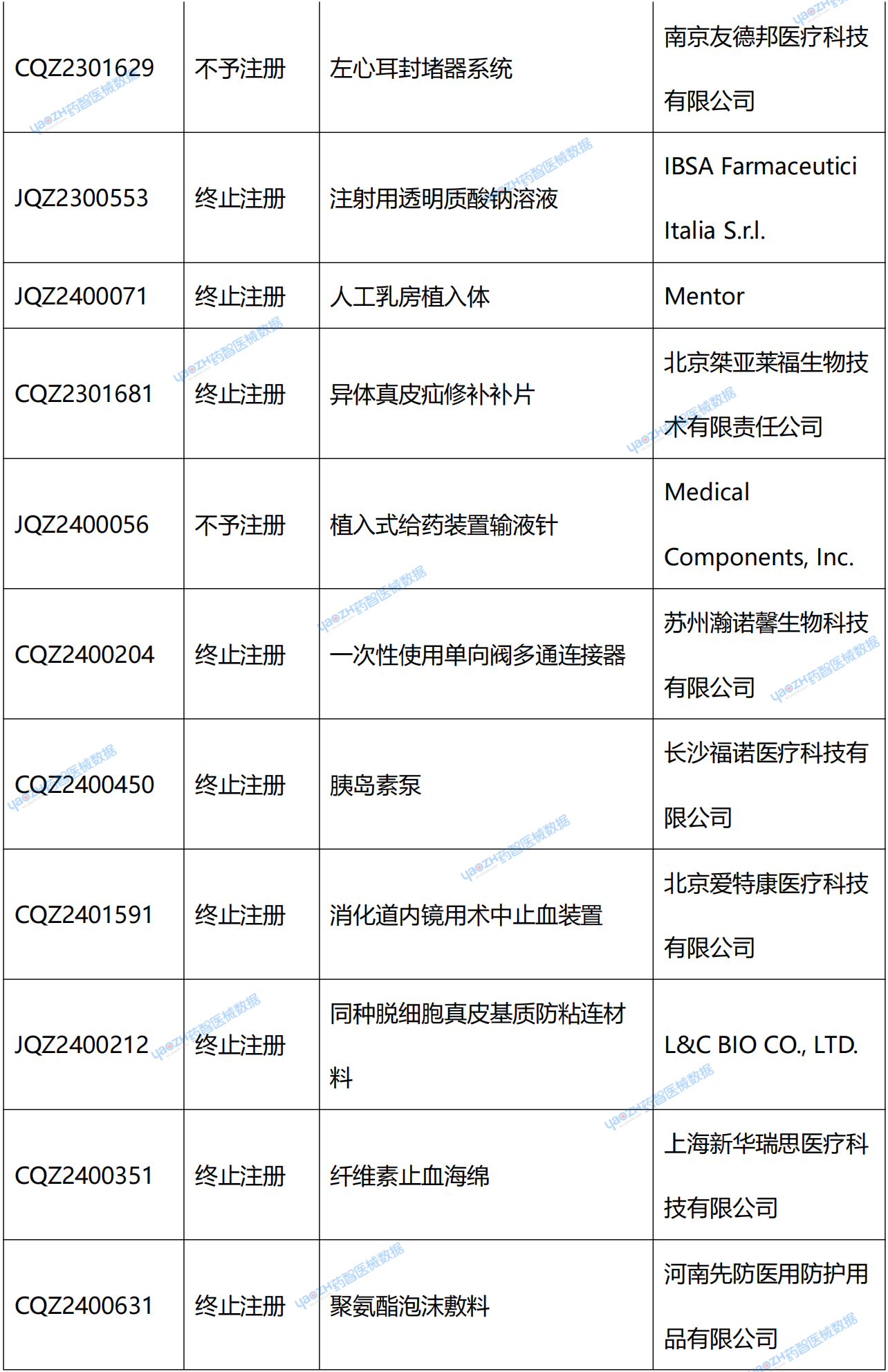
在NMPA官網中,可看到兩種退審公告:一種是醫療器械不予注冊批件送達信息;另一種是醫療器械終止注冊審查告知書送達信息。從結果上看,“終止注冊”和“不予注冊”都代表著獲證失敗。據藥智醫械數據統計,2025年2季度共67個新注冊產品受理號獲證失敗。(具體產品見文末)

圖片來源:NMPA官網
從《醫療器械注冊與備案管理辦法》可了解到,產品的成功獲批受到諸多因素的影響,包括產品的安全性或有效性問題、注冊資料不滿足注冊要求、發補資料回復超時等。
《醫療器械注冊與備案管理辦法》中的注冊不予通過的相關條款


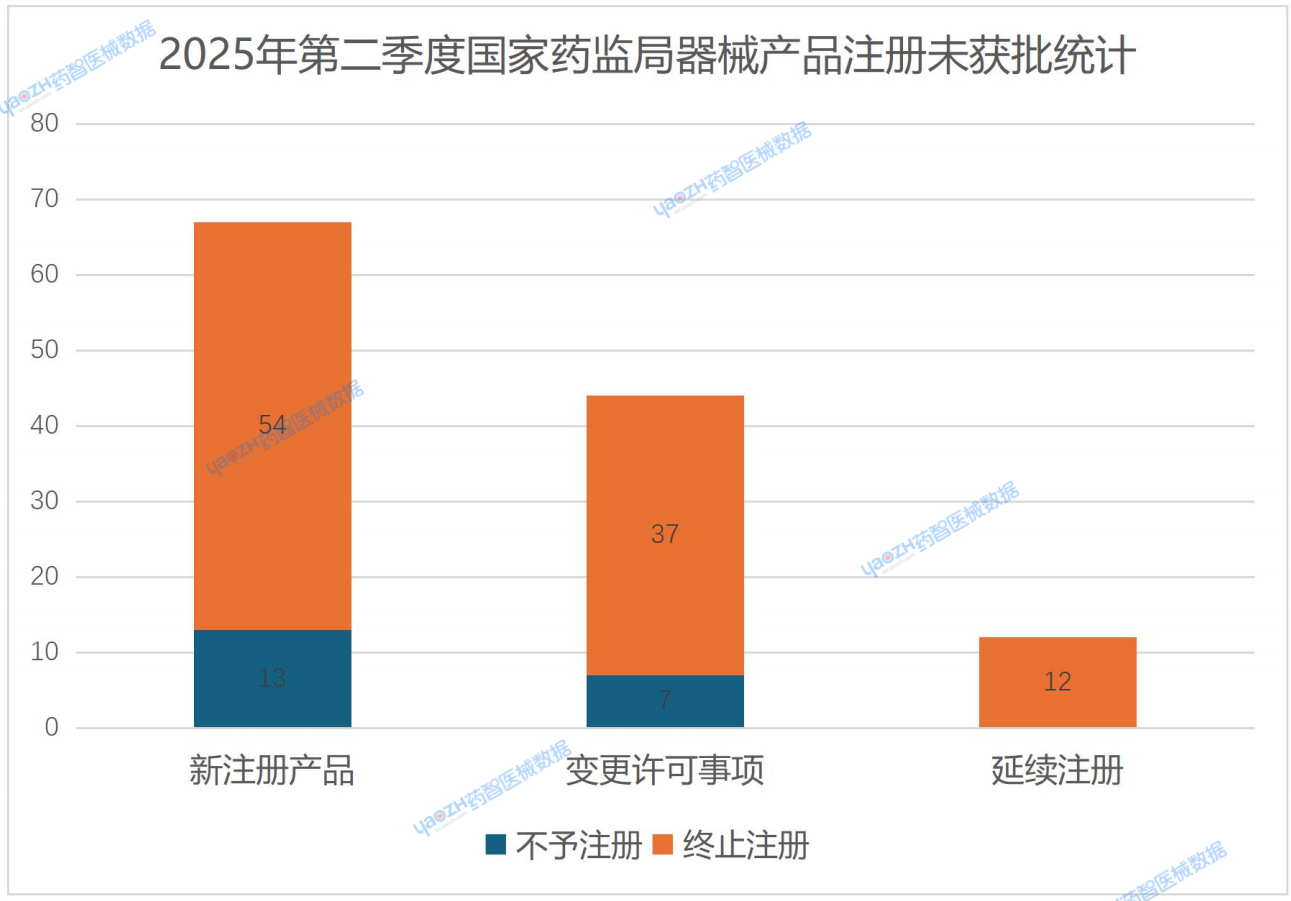
從下圖可知,產品中注冊未獲批的注冊類型以新注冊產品為主。在NMPA受理的產品分別是國產Ⅲ類和進口的Ⅱ、Ⅲ類產品。Ⅲ類器械產品的風險相對較高,在企業新注冊驗證不充分、或資料準備不足的情況下有審評不通過的風險。
資料來源:NMPA官網、藥智醫械數據
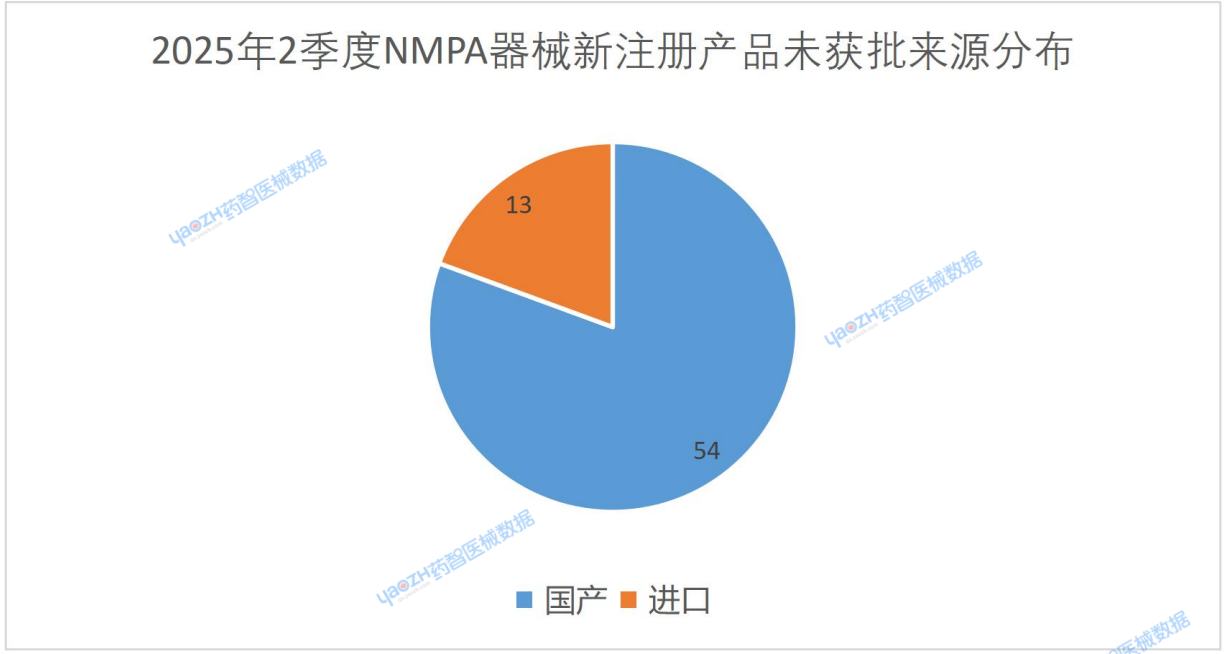
從下圖可知,新注冊未獲批的產品中,國產產品占比為80%。該數量遠遠超過2024年的平均水平—63%。但從根本原因分析,目前整個上市產品中,國產器械數量約為進口器械數量的3倍,國產器械申報基數大,導致未獲批數量相對較多。
資料來源:NMPA官網、藥智醫械數據
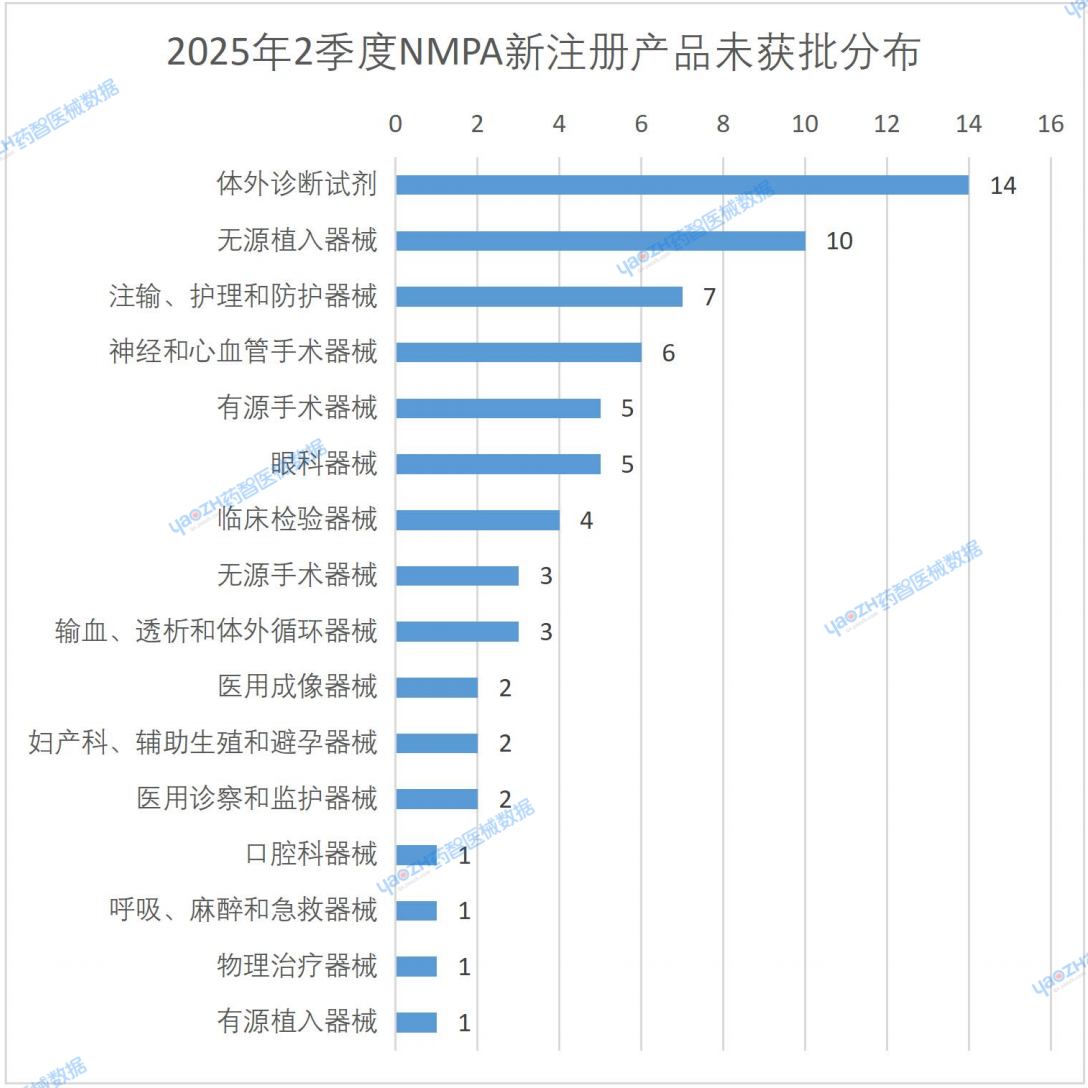
從下圖可知,新注冊但未獲批的產品分類TOP3為:體外診斷試劑(14款),無源植入器械(10款),注輸、護理和防護器械(7款)。
資料來源:NMPA官網、藥智醫械數據
總體上第二季度公布的新注冊醫療器械產品獲證失敗數量達到67個,相比一季度的185個下降了一倍多。從產品類型與產品未獲批數量來看,體外診斷試劑的基數較大,因此該類產品不獲批的數量也相對較大。并且,值得注意的是,未獲批的大部分產品從名稱上看,與當前已經上市的產品相差不大,但同時也可以看到有些獨家類型的品種未獲批。
此次未獲批的產品中,有一款手持呼吸式血糖檢測儀,由上海搖櫓儀器設備有限公司申報注冊。此產品通過呼吸氣體檢測血糖,屬于無創式檢測血糖,方便快捷,至今國內還無同類產品上市。雖然此產品未能獲批上市,但是面對血糖檢測這個龐大且具有剛性需求的市場,國內外企業還是由不少企業摩拳擦掌,躍躍欲試。
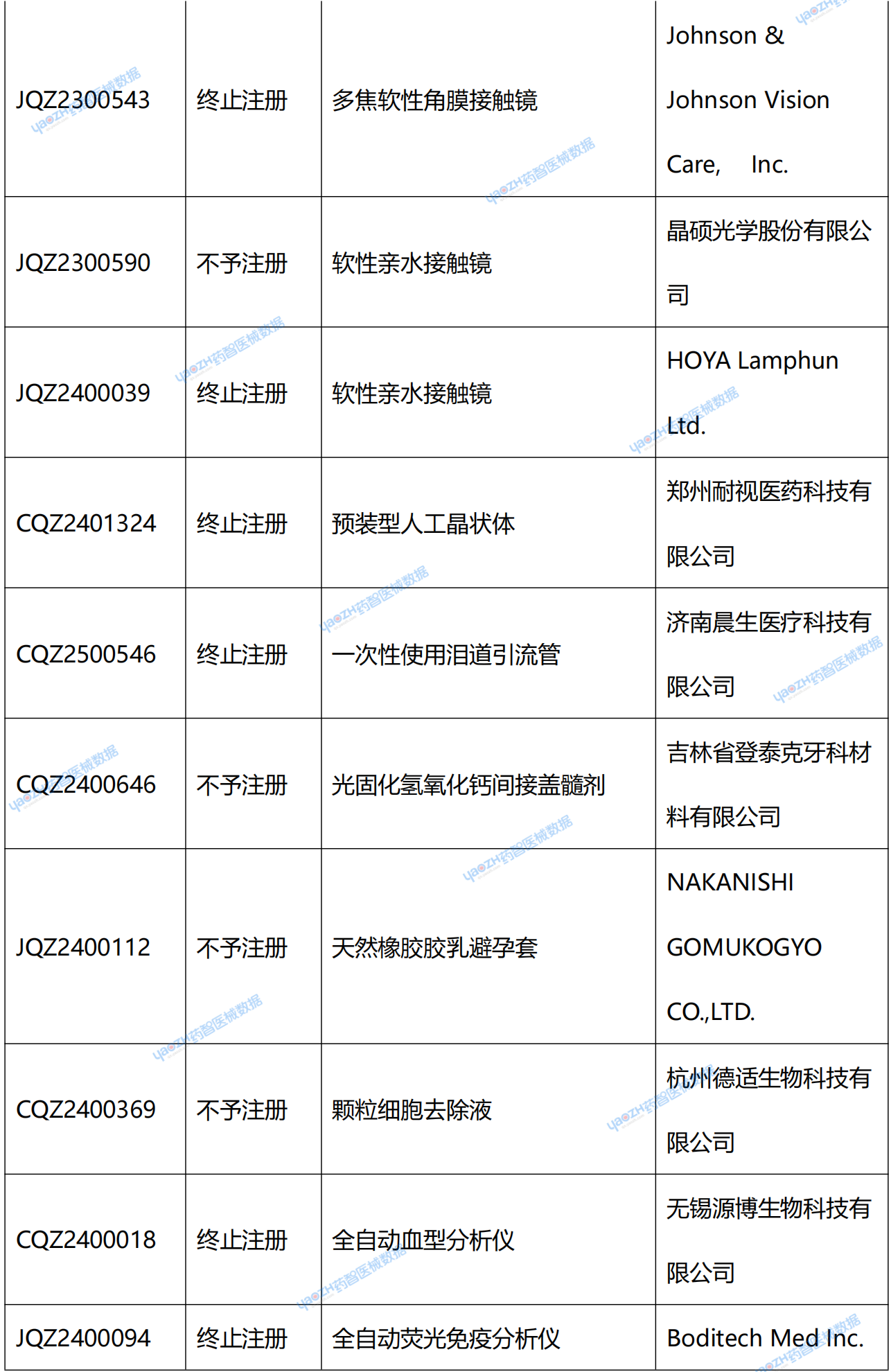
附錄:2025年2季度NMPA新注冊產品未獲批情況統計